Как найти массу раствора
Вычисление массы/массовой доли вещества в растворе
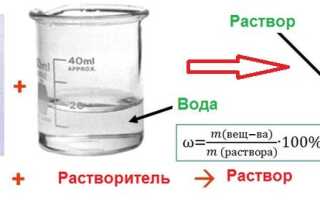
Массовой долей называют отношение массы данного компонента m(X) к массе всего раствора М(р-ра). Массовую долю обозначают символом ω (омега) и выражают в долях единицы или в процентах:
ω(Х) = m(Х)/М(р-ра) (в долях единицы);
ω(Х) = m(Х)• 100/М(р-ра) (в процентах).
Молярной концентрацией называют количество растворенного вещества в 1 л раствора. Ее обозначают символом с(Х) и измеряют в моль/л:
с(Х) = n(X)/V = m(X)/M(X) • V.
В этой формуле n(Х) — количество вещества Х, содержащегося в растворе, M(X) — молярная масса вещества Х.
Рассмотрим несколько типовых задач.
- Определить массу бромида натрия, содержащегося в 300 г 15%-ного раствора.
Решение.
Массу бромида натрия определим по формуле: m(NaBr) = ω • М(р-ра)/100;
m(NaBr) = 15•300/100 = 45 г.
Ответ: 45 г.
2. Масса нитрата калия, которую нужно растворить в 200 г воды для получения 8%-ного раствора, равна ______ г. (Ответ округлите до целого числа.)
Решение.
Пусть m(KNO3) = x г, тогда М(р-ра) = (200 + х) г.
Массовая доля нитрата калия в растворе:
ω(KNO3) = х/(200 + х) = 0,08;
х = 16 + 0,08х;
0,92х = 16;
х = 17,4.
После округления х = 17 г.
Ответ: 17 г.
3. Масса хлорида кальция, которую нужно добавить к 400 г 5%-ного раствора этой же соли, чтобы удвоить ее массовую долю, равна______ г. (Ответ запишите с точностью до десятых.)
Решение.
Масса CaCl2 в исходном растворе равна:
m(CaCl2) = ω • М(р-ра);
m(CaCl2) = 0,05 • 400 = 20 г.
Массовая доля CaCl2 в конечном растворе равна ω 1 = 0,05 • 2 = 0,1.
Пусть масса CaCl2, которую нужно добавить в исходный раствор, равна х г.
Тогда масса конечного раствора М1(р-ра) = (400 + х) г.
Массовая доля CaCl2 в конечном растворе:
Решив это уравнение, получим х = 22,2 г.
Ответ: 22,2 г.
4. Масса спирта, которую нужно испарить из 120 г 2%-ного спиртового раствора йода, чтобы повысить его концентрацию до 5%, равна _____________ г. (Ответ запишите с точностью до десятых.)
Решение.
Определим массу йода в исходном растворе:
m(I2) = ω • М(р-ра);
m(I2) = 0,02•120 = 2,4 г,
После выпаривания масса раствора стала равна:
М1(р-ра) = m(I2)/ω 1
М1(р-ра) =2,4/0,05 = 48 г.
По разности масс растворов находим массу испарившегося спирта: 120-48 = 72 г.
Ответ: 72 г.
5. Масса воды, которую нужно добавить к 200 г 20%-ного раствора бромида натрия, чтобы получить 5%-ный раствор, равна_________ г. (Ответ округлите до целого числа.)
Решение.
Определим массу бромида натрия в исходном растворе:
m(NaBr) = ω • М(р-ра);
m(NaBr) = 0,2 • 200 = 40 г.
Пусть масса воды, которую нужно добавить для разбавления раствора, равна x г, тогда по условию задачи:
Отсюда получим x = 600 г.
Ответ: 600 г.
6. Массовая доля сульфата натрия в растворе, полученном при смешении 200 г 5%-ного и 400 г 10%-ного растворов Na2SO4, равна _____________ %. (Ответ округлите до десятых.)
Решение.
Определим массу сульфата натрия в первом исходном растворе:
m1(Na2SO4) = 0,05 • 200 = 10 г.
Определим массу сульфата натрия во втором исходном растворе:
m2(Na2SO4) = 0,1 • 400 = 40 г.
Определим массу сульфата натрия в конечном растворе: m(Na2SO4) = 10 + 40 = 50 г.
Определим массу конечного раствора:М(р-ра) = 200 + 400 = 600 г.
Определим массовую долю Na2SO4 в конечном растворе: 50/600 = 8,3%
Ответ: 8,3%.
В дополнение к решению задач на растворы:
“Правилом креста” называют диагональную схему правила смешения для случаев с двумя растворами.
Слева на концах отрезков записывают исходные массовые доли растворов (обычно слева вверху-большая), на пересечении отрезков — заданная, а справа на их концах записываются разности между исходными и заданной массовыми долями. Получаемые массовые части показывают в каком отношении надо слить исходные растворы.
Например: Определите, сколько нужно взять растворов соли 60%-й и 10%-й концентраций для приготовления 300 г раствора 25%-й концентрации.
Масса одной части: 300/50 = 6 г.
Тогда
m1 = 6•15 = 90 г, .
m2 = 6•35 = 210 г.
Нужно смешать 90 г 60% раствора и 210 г 10% раствора.
Как найти массу растворителя в растворе?
Растворимость соединений, состоящих в одном гомологическом ряду значительно уменьшается в случае увеличения молекулярной массы, это связано с тем, что межмолекулярные силы взаимодействия повышаются.
К примеру, бензол способен полностью смешаться с этанолом, тогда как этанол и антрацен смешиваются только частично. Влияние молекулярной массы на общую растворимость особенно заметно в макромолекулах. Например, ацетон, спирт и концентрированная уксусная кислота способны легко растворить стирол, однако не могут растворить полистирол; винилацетат без проблем растворяется в эфирах и насыщенных углеводородах, но с поливинилацетатом такое не наблюдается. В спиртах не растворяется целлюлоза, в эфирах – полиэтиленгликоль, в винилхлориде – поливинилхлорид, в ацетонитриле – полиакрилонитрил, хотя наличие химического родства между этими полимерами и мономерами очевидно.
Из-за большой молекулярной массы структурированные полимеры не способны раствориться в растворителях даже при высокой температуре. Одна они способны набухать в присутствии растворителей в зависимости от плотности и природы поперечных связей.
В растворах общее соотношение количеств растворителя и растворенного вещества бывает разным. Если же количество растворенного вещества в отношении к растворителю довольно большое, то этот раствор называется концентрированным. В противном случает этот раствор считается слабым.
Масса раствора представляет собой сумму масс растворителя и растворенного вещества. К примеру, если 10 г сахара растворить в 100 г воды, то масса всего раствора составит 110 г. При описании любого раствора очень важной характеристикой считается его концентрация, т.е. сколько процентов занимает растворенное вещество в растворе. Например, если масса растворителя 647 равна 10 г, а масса раствора 110 г, то для нахождения концентрации 647 растворителя нужно 10 г разделить на 110 г, а результат умножить на 100%. Следовательно, 10г/110г*100%=9,09%.
Концентрация растворов точно описывает массовую долю всего растворенного вещества (w) – отношение всей массы растворенного вещества к массе раствора. Следует отметить, что именно отношение к массе самого раствора, а не к общей массе растворителя. Массовая доля выражается в процентах и в долях (безмерная величина).
Если же масса раствора будет составлять 200 г, а масса растворенного вещества в данном растворе равняется 50 г, то рассчитать массовую долю очень просто – 50/200 = 25% или 0,25. Также легко можно найти массовую долю самого растворителя. Она будет равна 200-50 = 150 г, таким образом, 150/200 = 75% или 0,75.
Дмитриевский химический завод — это ведущий производитель растворителей в России. Производство многокомпонентных растворителей, бутилацетата и уксусной кислоты реализуется уже более чем 100 лет. Поставляем растворители на ведущие автоконцерны России. Есть опция изготовления растворителя по рецептуре заказчика. Растворитель 646 от Дмитриевского химического завода – это продукт эталонного качества по доступной цене.
Алгоритм нахождения массы раствора
Курс повышения квалификации за 340 рублей!
Эмоциональное выгорание педагогов. Профилактика и способы преодоления
Алгоритм нахождения массы раствора.
1.Прочтите текст задачи.
2.Запишите кратко условие и требование задачи с помощью общепринятых обозначений.
3.Запишите формулу для расчета массы раствора по массе его компонентов:
m (р-ра)= m (в-ва)+ m ( H 2 O )
4.Запишите формулу для расчета массы раствора по массовой доле растворенного вещества: m (р-ра)=- m (в-ва) —–
5.Полученные в шагах 3и4 формулы сведите в одно уравнение с одним неизвестным х
(масса растворенного вещества) и решите его
m (р-ра)= m (в-ва)+ m ( H 2 O )= m (в-ва) —
6.Вычислите массу раствора по формуле (см. шаги 3 и 4)
1.Рассчитайте массу раствора, содержащего 160г. воды, если массовая доля сульфата меди в нем составляет 0,2.
4.m( р – ра )=- m(CuSO4) —–
7.Ответ: масса раствора 200г.
Добавляйте авторские материалы и получите призы от Инфоурок
Еженедельный призовой фонд 100 000 Р
При решение задач на нахождение массы раствора очень удобно пользоваться данным алгоритмом – “Алгоритм нахождения массы раствора”. Где последовательно описаны все действия, которые необходимо выполнить. Следуя этой инструкции легко решить задачу. В данном алгоритме показан пример решения задачи на данную тему.
- Дударева Надежда Викторовна
- Написать
- 314
- 19.04.2018
Номер материала: ДБ-1473730
Международные дистанционные олимпиады «Эрудит III»
Доступно для всех учеников
1-11 классов и дошкольников
Рекордно низкий оргвзнос
по разным предметам школьной программы (отдельные задания для дошкольников)
Идёт приём заявок
- 19.04.2018
- 210
- 18.04.2018
- 397
- 18.04.2018
- 206
- 18.04.2018
- 235
- 18.04.2018
- 399
- 18.04.2018
- 230
- 18.04.2018
- 677
- 18.04.2018
- 1850
Не нашли то что искали?
Вам будут интересны эти курсы:
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение редакции может не совпадать с точкой зрения авторов.
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако редакция сайта готова оказать всяческую поддержку в решении любых вопросов связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Источники:
http://himege.ru/vychislenie-massovoj-doli-veshhestva-v-rastvore/
http://www.dcpt.ru/otrasl/kak-nayti-massu-rastvoritelya-v-rastvore/
http://infourok.ru/algoritm-nahozhdeniya-massi-rastvora-2894529.html