Что входит в состав ядра
Физика атомного ядра. Состав ядра.
Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами).
Ядро было открыто Э. Резерфордом в 1911 г. при исследовании прохождения α-частиц через вещество. Оказалось, что почти вся масса атома (99,95%) сосредоточена в ядре. Размер атомного ядра имеет порядок величины 10 -1 3 -10 – 12 см, что в 10 000 раз меньше размера электронной оболочки.
Предложенная Э. Резерфордом планетарная модель атома и экспериментальное наблюдение им ядер водорода, выбитых α -частицами из ядер других элементов (1919-1920 гг.), привели ученого к представлению о протоне. Термин протон был введен в начале 20-х гг XX ст.
Протон (от греч. protons — первый, символ p) — стабильная элементарная частица, ядро атома водорода.
Протон — положительно заряженная частица, заряд которой по абсолютной величине равен заряду электрона e= 1,6 · 10 -1 9 Кл. Масса протона в 1836 раз больше массы электрона. Масса покоя протона mр= 1,6726231 · 10 -27 кг = 1,007276470 а.е.м.
Второй частицей, входящей в состав ядра, является нейтрон.
Нейтрон (от лат. neuter — ни тот, ви другой, символ n) — это элементарная частица, не имеющая заряда, т. е. нейтральная.
Масса нейтрона в 1839 раз превышает массу электрона. Масса нейтрона почти равна (незначительно больше) массе протона: масса покоя свободного нейтрона mn = 1,6749286 · 10 -27 кг = 1,0008664902 а.е.м. и превосходит массу протона па 2,5 массы электрона. Нейтрон, наряду с протоном под общим названием нуклон входит в состав атомных ядер.
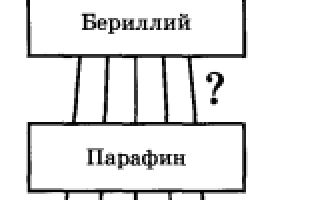
Нейтрон был открыт в 1932 г. учеником Э. Резерфорда Д. Чедвигом при бомбардировке бериллия α-частицами. Возникающее при этом излучение с большой проникающей способностью (преодолевало преграду из свинцовой пластины толщиной 10-20 см) усиливало свое действие при прохождении через парафиновую пластину (см. рисунок). Оценка энергии этих частиц по трекам в камере Вильсона, сделанная супругами Жолио-Кюри, и дополнительные наблюдения позволили исключить первоначальное предположение о том, что это γ-кванты. Большая проникающая способность новых частиц, названных нейтронами, объяснялась их электронейтральностью. Ведь заряженные частицы активно взаимодействуют с веществом и быстро теряют свою энергию. Существование нейтронов было предсказано Э. Резерфордом за 10 лет до опытов Д. Чедвига. При попадании α-частиц в ядра бериллия происходит следующая реакция:
Здесь — символ нейтрона; заряд его равен нулю, а относительная атомная масса приблизительно равна единице. Нейтрон — нестабильная частица: свободный нейтрон за время
15 мин. распадается на протон, электрон и нейтрино — частицу, лишенную массы покоя.
После открытия Дж. Чедвиком нейтрона в 1932 г. Д. Иваненко и В. Гейзенберг независимо друг от друга предложили протонно-нейтронную (нуклонную) модель ядра. Согласно этой модели, ядро состоит из протонов и нейтронов. Число протонов Z совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
Заряд ядра Q определяется числом протонов Z, входящих в состав ядра, и кратен абсолютной величине заряда электрона e:
Число Z называется зарядовым числом ядра или атомным номером.
Массовым числом ядра А называется общее число нуклонов, т. е. протонов и нейтронов, содержащихся в нем. Число нейтронов в ядре обозначается буквой N. Таким образом, массовое число равно:
Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение.
Представлению о составе ядра содействовало также открытие изотопов.
Изотопы (от греч. isos — равный, одинаковый и topoa — место) — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число протонов (Z) и различное число нейтронов (N).
Изотопами называются также ядра таких атомов. Изотопы являются нуклидами одного элемента. Нуклид (от лат. nucleus — ядро) — любое атомное ядро (соответственно атом) с заданными числами Z и N. Общее обозначение нуклидов имеет вид ……. где X — символ химического элемента, A = Z + N — массовое число.
Изотопы занимают одно и то же место в Периодической системе элементов, откуда и произошло их название. По своим ядерным свойствам (например, по способности вступать в ядерные реакции) изотопы, как правило, существенно отличаются. Химические (b почти в той же мере физические) свойства изотопов одинаковы. Это объясняется тем, что химические свойства элемента определяются зарядом ядра, поскольку именно он влияет на структуру электронной оболочки атома.
Исключением являются изотопы легких элементов. Изотопы водорода 1 Н — протий, 2 Н— дейтерий, 3 Н — тритий столь сильно отличаются по массе, что и их физические и химические свойства различны. Дейтерий стабилен (т.е. не радиоактивен) и входит в качестве небольшой примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода. Она при нормальном атмосферном давлении кипит при 101,2 °С и замерзает при +3,8 ºС. Тритий β-радиоактивен с периодом полураспада около 12 лет.
У всех химических элементов имеются изотопы. У некоторых элементов имеются только нестабильные (радиоактивные) изотопы. Для всех элементов искусственно получены радиоактивные изотопы.
Изотопы урана. У элемента урана есть два изотопа — с массовыми числами 235 и 238. Изотоп составляет всего 1/140 часть от более распространенного .
Что входит в состав ядра
Раздел ОГЭ по физике: 4.3. Состав атомного ядра. Изотопы.
Экспериментальное изучение строения атомного ядра осуществлял Резерфорд. Он облучал β-частицами атомы азота и других элементов.
Ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов. Протоны и нейтроны называются нуклонами. Число нуклонов в ядре называется массовым числом.
Заряд ядра кратен элементарному электрическому заряду Q = Ze. Число Z называется зарядовым числом, оно совпадает с номером элемента в периодической системе элементов Менделеева. Число нейтронов N равно разности массового и зарядового чисел: N = A – Z.
То, что ядра химических элементов устойчивы, нельзя объяснить гравитационным взаимодействием нуклонов:
- оно слишком мало, поскольку мала масса нуклонов;
- электромагнитное взаимодействие между этими частицами отсутствует, так как нейтрон не имеет электрического заряда.
Соответственно, между нуклонами в ядре действуют силы другой природы. Их называют ядерными силами, они характеризуют взаимодействие, называемое сильным. Ядерное взаимодействие очень сильное, но существует на малых расстояниях.
Ядро химического элемента обозначается как , где X – символ химического элемента. Например,
Например: в ядре атома лития содержится: протонов Z = 3 и нейтронов N = А — Z = 4.
Ядра одного и того же химического элемента могут содержать разное число нейтронов. При этом они имеют одинаковое зарядовое число, но разное массовое число. Например, ядра и имеют по 143 и 146 нейтронов соответственно. Ядра с одинаковым числом протонов, но различным числом нейтронов являются ядрами одного и того же химического элемента и называются изотопами.
Изотопы имеют одинаковые химические свойства, что обусловлено одинаковым электрическим зарядом ядра, но разные физические свойства.
Конспект урока «Состав атомного ядра. Изотопы».
Строение атомного ядра
Количественные показатели в радиоэкологии.
Особенностью радиоактивного загрязнения в отличие от загрязнения другими поллютантами является то, что вредное воздействие на человека и объекты окружающей среды оказывает не сам радионуклид (поллютант), а излучение, источником которого он является.
Однако бывают случаи, когда радионуклид – токсичный элемент. Например, после аварии на Чернобыльской АЭС в окружающую среду с частицами ядерного топлива были выброшены плутоний 239, 242 Рu. Кроме того, что плутоний – альфа-излучатель и при попадании внутрь организма представляет значительную опасность, плутоний сам по себе – токсичный элемент.
По этой причине используют две группы количественных показателей: 1) для оценки содержания радионуклидов и 2) для оценки воздействия излучения на объект.
Активность – количественная мера содержания радионуклидов в анализируемом объекте. Активность определяется числом радиоактивных распадов атомов в единицу времени. Единицей измерения активности в системе СИ является Беккерель (Бк) равный одному распаду в секунду (1Бк = 1 расп/с). Иногда используется внесистемная единица измерения активности – Кюри (Ки); 1Ки = 3,7 ×1010 Бк.
Доза излучения – количественная мера воздействия излучения на объект.
В связи с тем, что воздействие излучения на объект можно оценивать на разных уровнях: физическом, химическом, биологическом; на уровне отдельных молекул, клеток, тканей или организмов и т. д., используют несколько видов доз: поглощенную, эффективную эквивалентную, экспозиционную.
Для оценки изменения дозы излучения во времени используют показатель «мощность дозы». Мощность дозы – это отношение дозы ко времени. Например, мощность дозы внешнего облучения от естественных источников радиации составляет на территории России 4-20 мкР/ч.
Основной норматив для человека – основной дозовый предел (1 мЗв/год) – вводится в единицах, эффективной эквивалентной дозы. Существуют нормативы и в единицах активности, уровни загрязнения земель, ВДУ, ПГП, СанПиН и др.
Строение атомного ядра.
Атом – это мельчайшая частица химического элемента, сохраняющая все его свойства. По своей структуре атом представляет сложную систему, состоящую из находящегося в центре атома положительно заряженного ядра очень малого размера (10 -13 см) и отрицательно заряженных электронов, вращающихся вокруг ядра на различных орбитах. Отрицательный заряд электронов равен положительному заряду ядра, при этом в целом оказывается электрически нейтральным.
Атомные ядра состоят из нуклонов – ядерных протонов (Z – число протонов) и ядерных нейтронов (N – число нейтронов). « Ядерные» протоны и нейтроны отличаются от частиц в свободном состоянии. Например, свободный нейтрон, в отличие от связанного в ядре, нестабилен и превращается в протон и электрон.
Число нуклонов Ам (массовое число) представляет собой сумму чисел протонов и нейтронов: Ам = Z+ N.
Протон – элементарная частица любого атома, он имеет положительный заряд, равный заряду электрона. Число электронов в оболочке атома определяется числом протонов в ядре.
Нейтрон – другой вид ядерных частиц всех элементов. Его нет лишь в ядре легкого водорода, состоящего из одного протона. Он не имеет заряда, электрически нейтрален. В атомном ядре нейтроны являются стабильными, а в свободном состоянии они неустойчивы. Число нейтронов в ядрах атомов одного и того же элемента может колебаться, поэтому число нейтронов в ядре не характеризует элемент.
Нуклоны (протоны + нейтроны) удерживаются внутри атомного ядра ядерными силами притяжения. Ядерные силы в 100 раз сильнее электромагнитных сил и поэтому удерживает внутри ядра одноименно заряженные протоны. Ядерные силы проявляются только на очень малых расстояниях (10 -13 см), они составляют потенциальную энергию связи ядра, которая при некоторых превращениях частично освобождается, переходит в кинетическую энергию.
Для атомов отличающихся составом ядра, употребляется название «нуклиды», а для радиоактивных атомов – «радионуклиды».
Нуклидами называют атомы или ядра с данным числом нуклонов и данным зарядом ядра (обозначение нуклида А Х).
Нуклиды, имеющие одинаковое число нуклонов (Ам = соnst), называются изобарами. Например, нуклиды 96 Sr, 96 Y, 96 Zr принадлежат к ряду изобаров с числом нуклонов Ам = 96.
Нуклиды, имеющие одинаковое число протонов (Z = соnst), называются изотопами. Они различаются только числом нейтронов, поэтому принадлежат одному и тому же элементу: 234 U, 235 U, 236 U, 238 U.
Изотопы – нуклиды с одинаковым числом нейтронов (N = Ам -Z = const). Нуклиды: 36 S, 37 Cl, 38 Ar, 39 K, 40 Ca принадлежат к ряду изотопов с 20 нейтронами.
Изотопы принято обозначать в виде ZХ М , где X – символ химического элемента; М – массовое число, равное сумме числа протонов и нейтронов в ядре; Z – атомный номер или заряд ядра, равный числу протонов в ядре. Поскольку каждый химический элемент имеет свой постоянный атомный номер, то его обычно опускают и ограничиваются написанием только массового числа, например: 3 Н, 14 С, 137 Сs, 90 Sr и т. д.
Атомы ядра, которые имеют одинаковые массовые числа, но разные заряды и, следственно, различные свойства называют «изобарами», так например один из изотопов фосфора имеет массовое число 32 – 15Р 32 , такое же массовое число имеет и один из изотопов серы – 16S 32 .
Нуклиды могут быть стабильными (если их ядра устойчивы и не распадаются) и нестабильными (если их ядра неустойчивы и подвергаются изменениям, приводящим в конечном итоге к увеличению стабильности ядра). Неустойчивые атомные ядра, способные самопроизвольно распадаться, называют радионуклидами. Явление самопроизвольного распада ядра атома, сопровождающееся излучением частиц и (или) электромагнитного излучения, называется радиоактивностью.
В результате радиоактивного распада может образоваться как стабильный, так и радиоактивный изотоп, в свою очередь, самопроизвольно распадающийся. Такие цепочки радиоактивных элементов, связанные серией ядерных превращений, называются радиоактивными семействами.
В настоящее время IUРАС (Международный союз теоретической и прикладной химии) официально дал название 109 химическим элементам. Из них только 81 имеет стабильные изотопы, наиболее тяжелым из которых является висмут (Z = 83). Для остальных 28 элементов известны только радиоактивные изотопы, причем уран (U
92) является самым тяжелым элементом, встречающимся в природе. Самый большой из природных нуклидов имеет 238 нуклонов. В общей сложности в настоящее время доказано существование порядка 1700 нуклидов этих 109 элементов, причем число изотопов, известных для отдельных элементов, колеблется от 3 (для водорода) до 29 (для платины).
Источники:
http://www.calc.ru/Fizika-Atomnogo-Yadra-Sostav-Yadra.html
http://uchitel.pro/%D1%81%D0%BE%D1%81%D1%82%D0%B0%D0%B2-%D0%B0%D1%82%D0%BE%D0%BC%D0%BD%D0%BE%D0%B3%D0%BE-%D1%8F%D0%B4%D1%80%D0%B0-%D0%B8%D0%B7%D0%BE%D1%82%D0%BE%D0%BF%D1%8B/
http://studopedia.ru/4_170109_stroenie-atomnogo-yadra.html